在这个脑区打响抗击抑郁“第一枪”
发布日期:2024-11-11 作者:锻錾器物粉”,后来因为临床上意外发现的快速抗抑郁效果,让科学家看到了研发高效抗抑郁药物的希望。从“魔鬼”到“天使”的切换,最大的挑战来自于:人们能否准确地把握抗抑郁的核心机制。
浙江大学胡海岚教授团队研究之后发现:在进入抑郁大脑后,特异性地靶向了大脑中的“反奖赏中心”——外侧缰核脑区(LHb),该脑区神经元上的NMDA受体是起效的初始靶点。研究团队阐述了脑区特异性现象背后的神经学基础,并界定了神经信号从外侧缰核到海马脑区的上下游关系。
此前,胡海岚团队分别于2018年、2023年在Nature杂志发表论文阐述的快速和长效抗抑郁机制。最新的研究论文Brain region–specific action of ketamine as a rapid antidepressant于2024年8月9日发表在Science杂志,为的抗抑郁“路线”完成了一块重要的“拼图”。它与前两项研究一起,构建起以外侧缰核NMDA受体为核心的抗抑郁理论,这将为临床上的用药策略以及新型药物的研发提供理论指导。
已有研究表明:主要是通过结合神经元上的NMDA受体而起效的。也就是说,的主要分子靶点是NMDA受体。但是,NMDA受体在全脑广泛表达、分布,是同步作用于全脑,还是首先作用于个别脑区?这在学术界尚无定论,也是理解作用机制的关键问题。
要回答这样的一个问题并不简单。胡海岚团队2018年发表的研究指出,的一个去向是外侧缰核,它能遏制外侧缰核神经元的簇状放电从而缓解抑郁。其他科研团队的研究则提示,影响了大脑中的海马区、皮层区等,引起了这些区域神经可塑性方面的向好变化。到底孰先孰后或是“平行”发生,学术界缺乏直接的实验证据。
“快速起效的特性,为咱们提供了时间上的区分度。”论文第一作者、博士后陈敏介绍了他们设计的一组实验:在抑郁小鼠的腹腔注射,观察小鼠大脑在极短的时间内发生的变化。“在几分钟到1、2小时的时间尺度内,外侧缰核的神经元活性出现了显著下降;但让人惊讶的是,海马和皮层等其他脑区的神经元活性基本上没有任何改变。”
无论是体外脑片观察还是在体电生理记录,都显示外侧缰核都是最先响应的脑区。“这说明对NMDA受体的作用呈现脑区特异性,而不是同步作用于多个脑区。最先响应的脑区标志着它与有更直接的相互作用。”胡海岚说。
作为一种有机小分子,怎么会做出 “选择”从而在特异脑区起效呢?胡海岚认为这不仅取决于本身,更大的因素来自于与神经元的相互作用方式,以及局部神经元的活动特性。为此,研究团队对比观察了抑郁症小鼠中的外侧缰核和海马两个脑区。
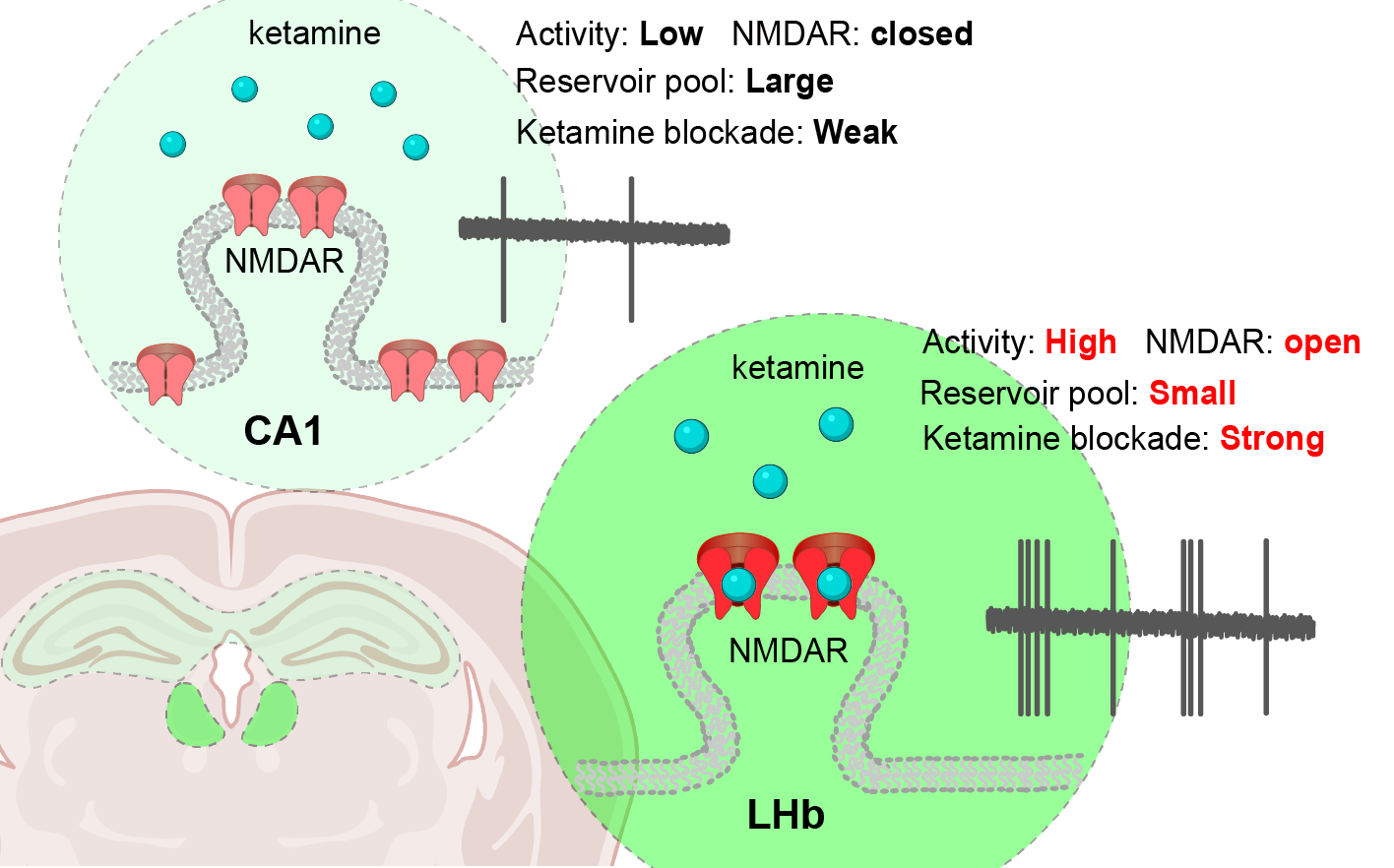
“NMDA受体是一种离子通道,它们在神经元活跃时开放。”论文第二作者马爽爽博士介绍,而的靶向位点在离子通道的内部,在神经元活跃NMDA受体打开时,才能趁机而入。因此它的阻断具有活动性依赖的特点。”实验显示,抑郁大脑外侧缰核神经元的活动性明显高于海马椎体神经元,这导致了有更多的机会结合阻断外侧缰核的NMDA受体。研究人员还尝试调节两个脑区的神经元的活动性,成功逆转了它们对于的敏感程度。
细察两个脑区神经元的突触,研究人员还发现一处不同:外侧缰核神经元的突触外NMDA受体储备明显小于海马神经元。研究团队认为这在某种程度上预示着少量的就能“覆盖”外侧缰核的NMDA受体,从而表现出更高的“阻断效率”。
由此,关于的脑区特异性机制,胡海岚团队指出其背后有多重的神经学基础:它是由活动依赖的药物特性、不同脑区神经元的活动性高低以及不同脑区突触外NMDA受体的储备等多种因素共同介导的。
对于分子靶点的追踪,胡海岚团队已从NMDA受体这一大类分子,聚焦到到特定脑区的NMDA受体,指出外侧缰核的NMDA受体是作用的关键靶点。然而,对于抗抑郁作用的核心机制,不仅需要有分子靶点的描述,更需要在神经环路层面揭示初始靶点,特别是上游和下游的关系。
已有的研究提示,除了外侧缰核,还有别的的脑区也参与了的抗抑郁作用。比如,经腹腔注射还引起了海马区五羟色胺和神经生长因子BDNF的升高,但没有现成的证据说明谁是主因。对此,研究人员设计了一组实验:特异性局部敲除小鼠外侧缰核神经元的NR1(NMDA受体的亚基),就不再具有快速抗抑郁的行为学效果。对这只小鼠同样进行腹腔注射,它海马区的五羟色胺和BDNF没再次出现明显的升高。
“这说明,外侧缰核是作用的起始脑区,其在海马引起的反应很可能是作为下游反应参与了的抗抑郁作用。”胡海岚说。如果把在脑内的作用路径比作是打保龄球,外侧缰核神经元的NMDA受体就是这里面的“1号球瓶”,在推倒“1号球瓶”后触发了其他“球瓶”的系列反应。
“为人类认识和攻克抑郁症提供了一把钥匙。”自本世纪快速抗抑郁效果被发现以来,学术界涌现了大量抗抑郁机制的研究。胡海岚研究团队是其中特色鲜明的一支,他们开创了全新的研究视角,构建了以外侧缰核NMDA受体为核心的抗抑郁理论体系。
2018年,胡海岚研究团队在Nature发文阐述快速抗抑郁的脑机制,首次将抑郁症与外侧缰核的簇状放电联系起来,指出能通过结合外侧缰核神经元上的NMDA受体抑制簇状放电;2023年研究团队再次在Nature发文,阐释长效抗抑郁的脑机制,指出独特的“嵌入式”作用机制促成了其药效维持的时间远高于其半衰期。此次Science的论文则致力于回答脑区特异性机制和药物作用的上下游关系,这为完整理解抗抑郁机制添加了一块重要“拼图”,为的临床用药和新型抗抑郁药物的研发改造提供了理论指导。
在理解的抗抑郁机制方面,学术界目前主要有两种主流的学说:一种是“去抑制”假说,认为抗抑郁是由于大脑中的“乌云”被驱散了,是通过抑制了脑内过度激活的“刹车”从而缓解抑郁情绪的;而另一种是“神经可塑”假说,认为抗抑郁是由于增加了让大脑快乐的物质或连接,能促发大脑产生更多利于神经生长和建立突触的物质。胡海岚最新的这项研究,一方面为外侧缰核在“去抑制”过程中的核心作用提供了直接的实验证据;另一方面也不否认神经可塑性的影响,并进一步界定了外侧缰核脑区和其他脑区的神经可塑性变化在抗抑郁路径上的先后联系。“这一工作将以上两种假说自然地联系在一起,也为以往研究中发现的多种机制提供了更为统一的解释。”胡海岚说。
胡海岚研究团队的一系列研究也引发了临床上的关注与跟进。此前,抑郁症临床治疗的常见手段——深部脑刺激(DBS)很少注意到缰核脑区,自2018年团队发文指出外侧缰核的主体地位以来,临床上开展了更大样本的缰核DBS治疗抑郁的研究。上海瑞金医院和北京301医院利用DBS抑制缰核放电,尝试对13例难治型抑郁患者进行及时有效的治疗,其中11例取得了显著的疗效。“临床上的反馈进一步支持了我们以外侧缰核为核心的抑郁症新理论,也更加激励我们继续深入探索核心机制,为人类最终攻克抑郁症而努力。”马爽爽说。
浙江大学医学院脑科学与脑医学学院/教育部脑与脑机融合前沿科学中心/脑机智能全国重点实验室/良渚实验室/新基石研究员胡海岚教授是本文的通讯作者,博士后陈敏为第一作者。此外,博士生马爽爽、特聘研究员刘含笑、博士生董一言、汤景翔、倪哲一、段陈迟、博士后檀毅、李辉、杨艳副教授、华盛顿大学Christopher Lingle教授等也在其中做出了重要贡献。本研究还得到了浙江大学段树民教授、黄荷凤教授,华东师范大学曹晓华教授、北京大学李毓龙教授的全力支持。李启靖教授、Carlos Zarate教授、李浩洪教授为本研究提供了宝贵的指导和建议。该研究主要受科学技术创新2030重点项目、国家自然科学基金、上海高等研究院繁星科学基金、新基石科学基金等项目的资助。

